리튬이온 배터리 원리
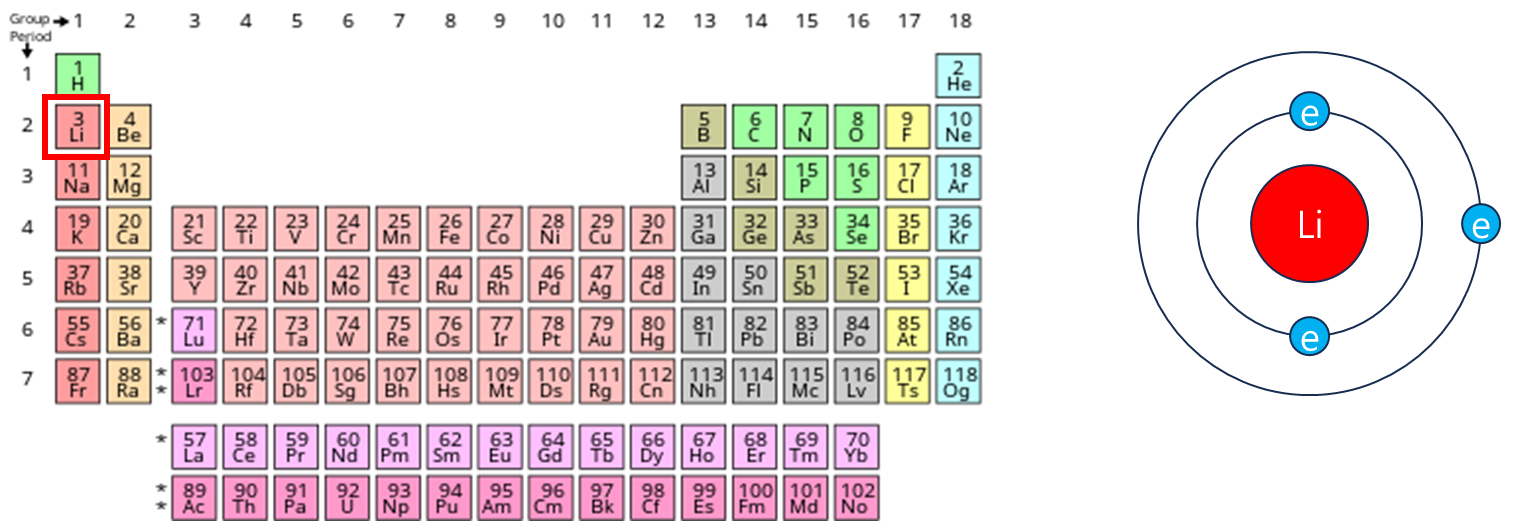
왜 리튬을 사용할까?
배터리 역할을 고려 했을 때, 전자를 쉽게 잃으려는 금속을 사용해야 전자의 흐름을 쉽게 이끌어 낼 수 있다.
아래 표를 보면 Li(리튬)이 전자를 잃고 이온이 되려는 성질이 가장 강하기에 배터리로 사용하기 가장 적합하며

원자번호 3번밖에 안되는 가벼운 금속이기 때문에 휴대용 배터리로 사용하기에도 제격이다.
산화반응과 환원반응
산화반응은 전자를 잃는 것을 말하며 환원반응은 전자를 얻는 것을 말한다.
예를들어 Na(나트륨)의 최외곽 전자 개수는 1개이고 Cl(염소)는 7개인데
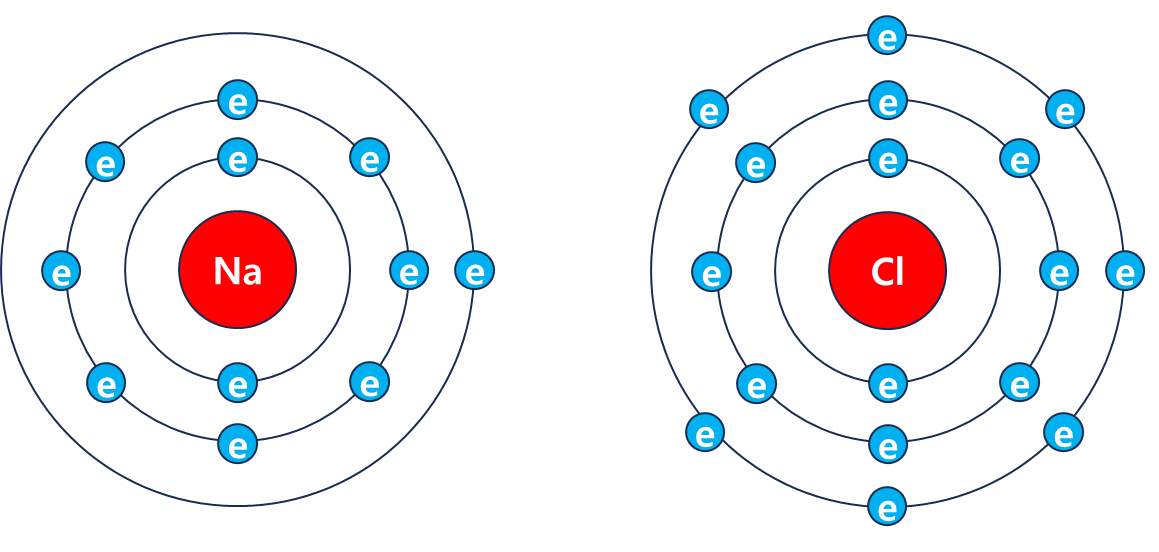
화학적 특성상 외곽의 전자 개수는 8개로 구성되어야 안정하기 때문에 Na(나트륨)과 Cl(염소)가 만나면 Na의 전자 1개를 Cl에게 주면서 서로 결합하게된다. 이렇게 결합된 NaCl(염화나트륨)을 우린 소금이라고도 한다.
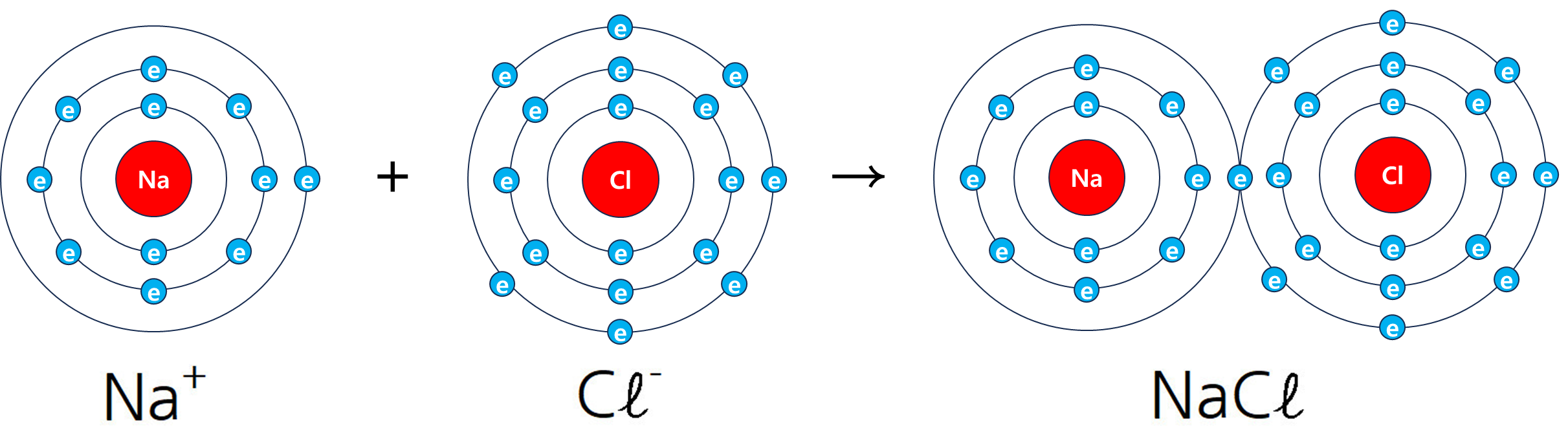
여기서 Cl에게 전자를 준 Na은 산화되었다고 하고, Na에게 전자를 받은 Cl은 환원되었다고 한다.
리튬이온 배터리 구조
배터리는 결국 전자를 잃는 산화반응과 전자를 다시 얻는 환원반응을 통해 배터리를 사용하고 충전하게 된다.
따라서 배터리 구조는 이런 반응을 잘 이용하도록 구성되어 있다.
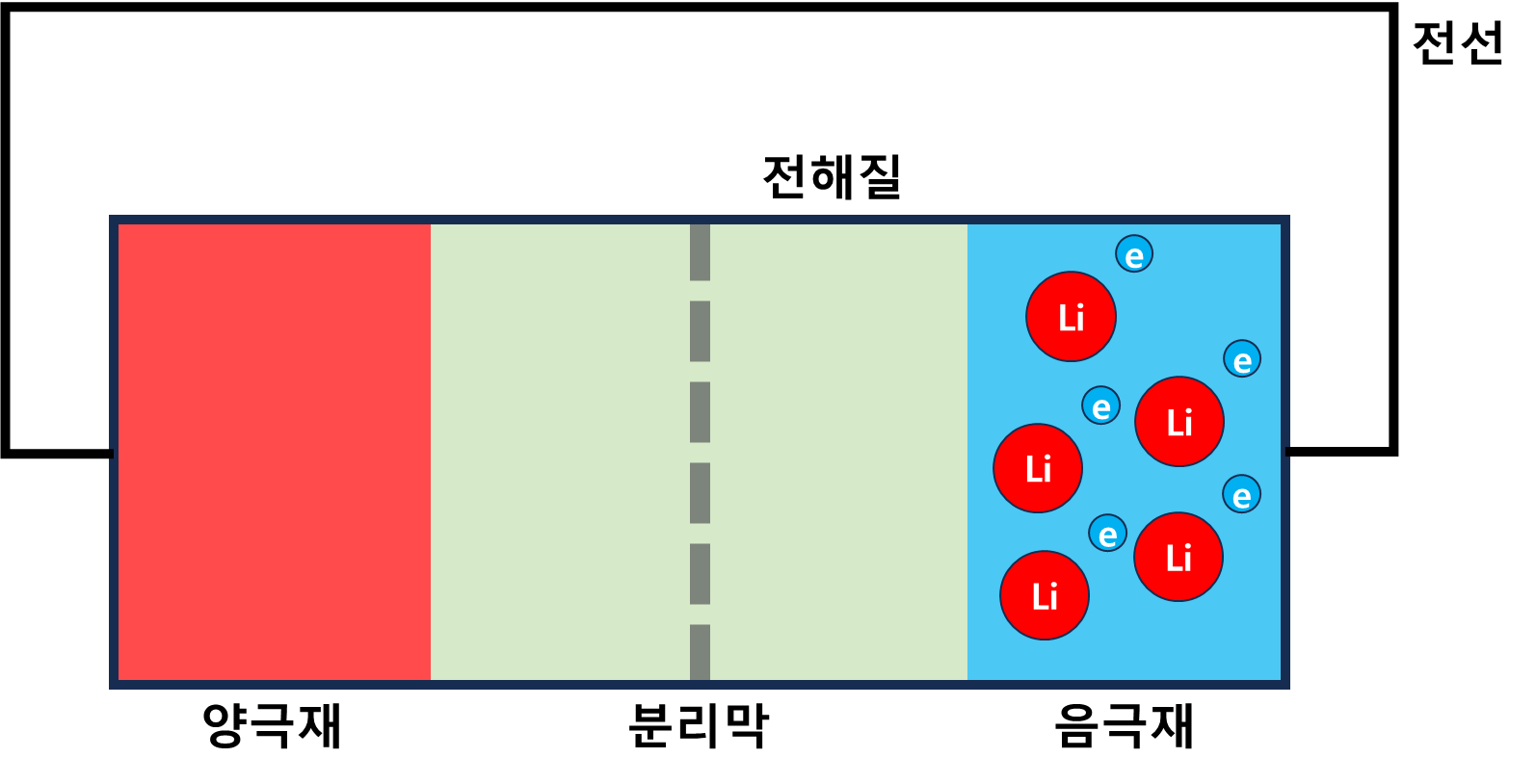
- 양극재 : 산화금속으로 이루어져 있으며, 리튬이 산화반응을 할 수 있게 해준다.
- 음극재 : 리튬을 저장하는 저장소 역할을 한다.
- 전해질 : 리튬이 양극재와 음극재 사이를 잘 이동할 수 있게 해준다.
- 분리막 : 전자의 이동을 막아준다.
- 전선 : 전자가 이동할 수 있는 통로 역할을 한다.
- 리튬 : 산화반응을 일으켜 전선을 통해 전류를 흐르게 한다.
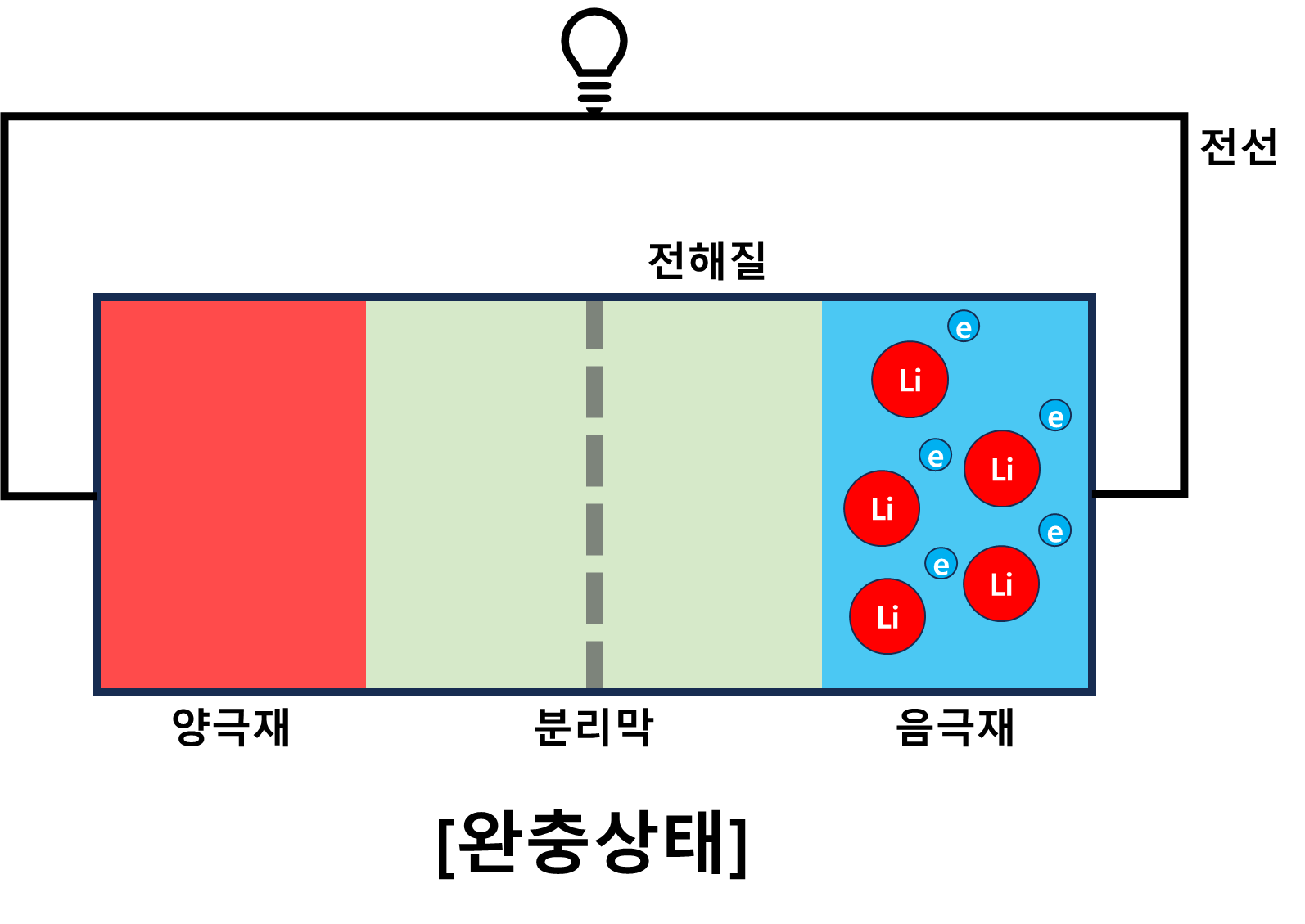
리튬이온 배터리 사용 원리
완충상태의 배터리는 음극재에 리튬이 저장되어 있는 상태이다. 리튬은 산화되려는 성질이 있기 때문에 양극재에 있는 산소쪽으로 이동해 산화반응을 일으키려할 것이다. 이때, 리튬은 최외곽전자를 잃어버리게 되는데 이렇게 잃어버린 전자는 분리막을 통과할 수 없기 때문에 전선을 통해 이동하며 전류를 만들게 된다.
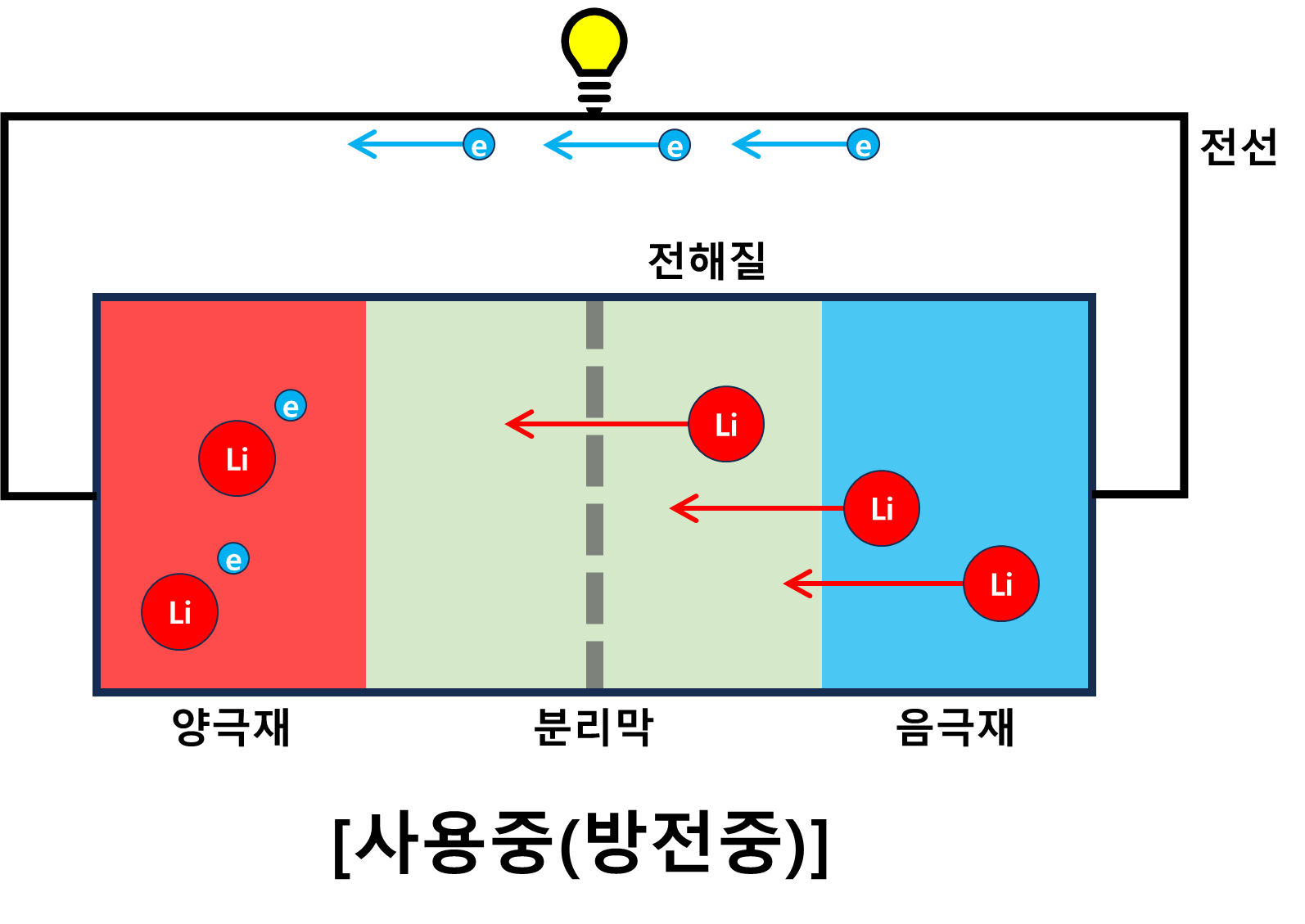
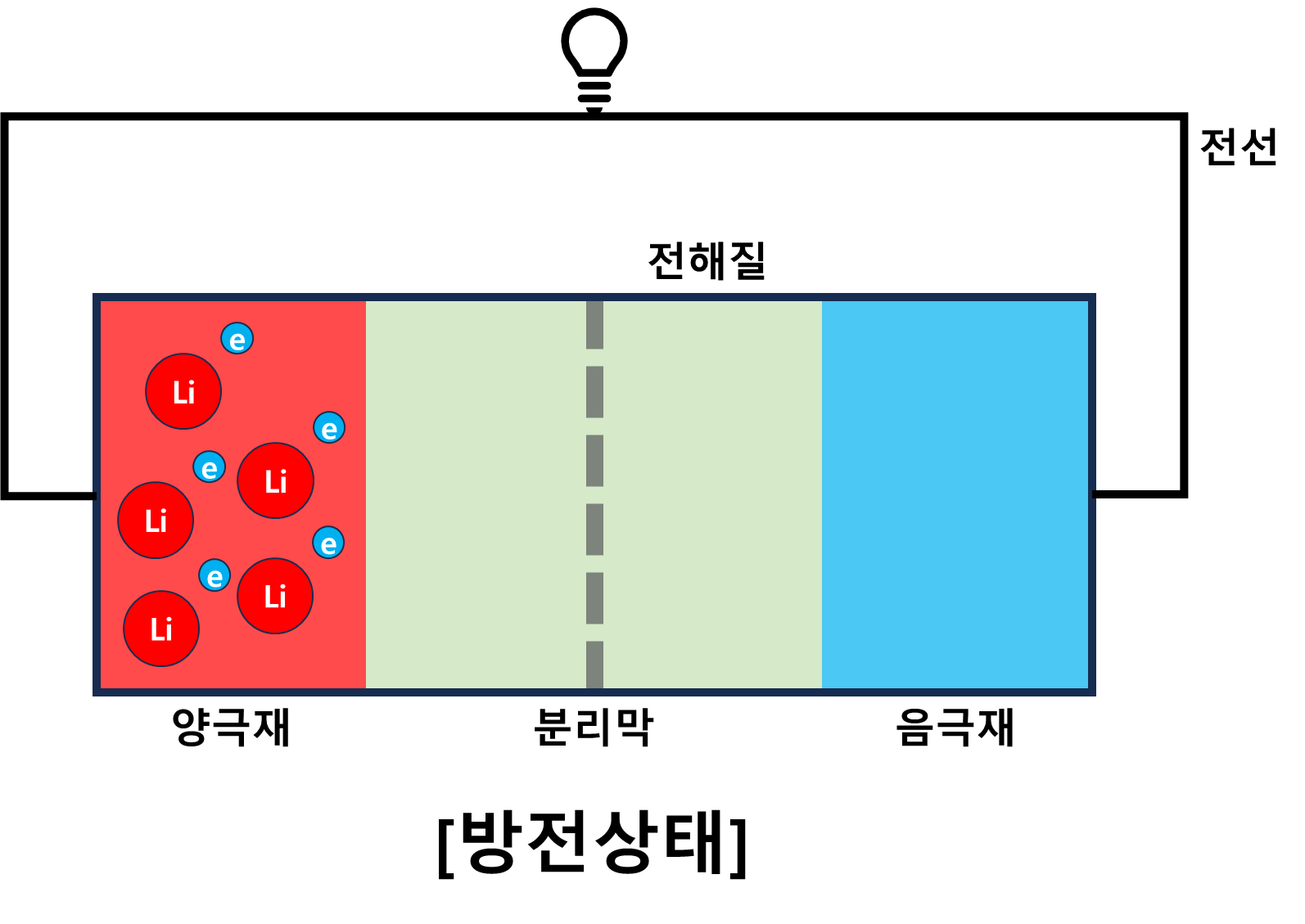
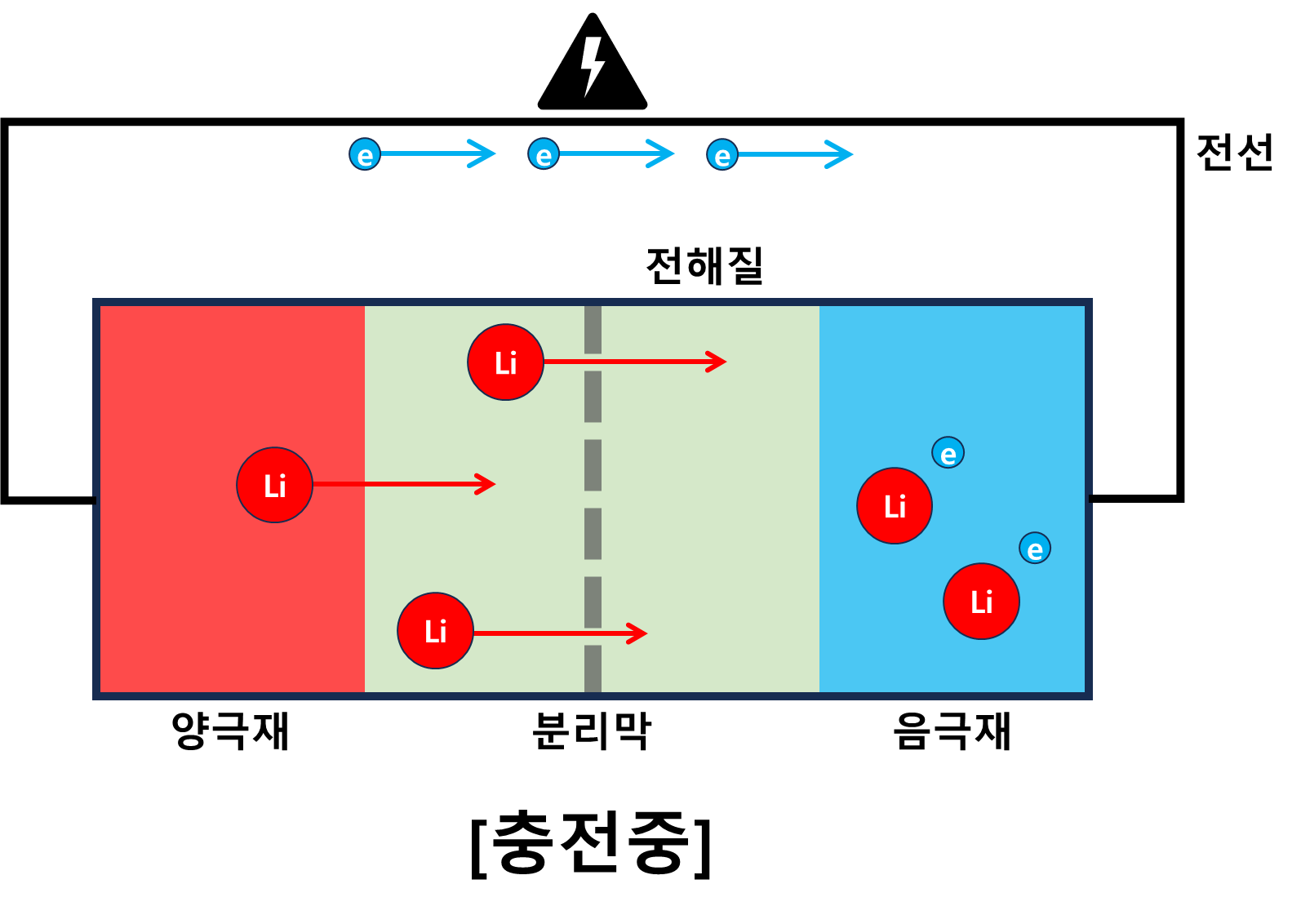
리튬이온 배터리 충전 원리
방전상태의 배터리에는 리튬이온이 모두 양극재에서 산화된 상태로 존재한다. 더 이상의 산화반응이 일어나지 않기에 전류가 흐르지 않는다. 이때, 충전기와 같은 외부 에너지를 이용해 양극재의 전자를 강재로 음극재로 이동시키면 양극재는 전체적으로 양(+)의 상태가 되고 전자를 하나 잃고 +상태인 리튬이온은 다시 음극재에 있는 전자를 얻기위해 음극재로 이동하게 될 것이다. 이때, 음극재에서 환원반응이 일어나고 리튬이온은 다시 전자를 얻게 된다.